高铁酸钾的制备及其处理生活污水的实效研究
高铁酸钾的制备及其处理生活污水的实效研究
摘要:通过次氯酸盐氧化法稳定合成高纯度的高铁酸钾(K2FeO4),并将其应用于处理生活污水。试验结果表明,在优化合成工艺条件下,可以得到纯度达99%以上的高铁酸钾。高铁酸钾对生活污水中COD、浊度和氨氮等去除效果明显。投加一定量的高铁酸钾可以使该水体达到再生水水质的国家标准,实现水资源循环利用。
关键词:高铁酸钾;制备;水处理
传统的水处理剂如聚合氯化铝、氯气等都会对水体形成二次污染,为弥补以上不足,近年来开发出一种新型、高效、多功能的水处理剂高铁酸钾 (K2FeO4),它集氧化、消毒、吸附、絮凝、助凝、杀菌和去污为一体,而且安全性有可靠保证[1-2]。但高铁酸钾中Fe呈正6价,在溶液中稳定性不好,自身热稳定性差,再加上制备方法复杂、操作困难,因此,目前还未有理想的商品高铁酸钾面市[3]。
本文研究了高纯度高铁酸钾的稳定合成条件,对自制的高铁酸钾产品进行定性定量的分析,以重庆大学某处生活污水为研究对象,实测高铁酸钾对水体中污染指标COD、浊度和氨氮的去除情况,从而提出了处理校园生活污水的一种新方法。
1 试验部分
1.1高铁酸钾的制备
NaClO溶液中依次加入NaOH、Fe(NO3)·39H2O 和少量复合稳定剂,用磁力搅拌器搅拌至溶液呈深紫红色,再加入固体NaOH至饱和。将反应液放料、离心,用真空泵抽滤。取滤液,再投加饱和KOH溶液,保持溶液20℃,并持续搅拌15min,抽滤。滤渣经后处理,包括重结晶、有机物洗涤纯化和真空干燥后得到固体高铁酸钾产品。
1.2高铁酸钾的定性定量分析
将上述产品用Nicolet IR-550Ⅱ型红外光谱仪测试,其图谱与文献[4]中高铁酸钾的标准图谱基本一致,证明其为K2FeO4。产品用亚铬酸盐氧化还原滴定法测其纯度为99.1%。
1.3高铁酸钾水处理效果
取重庆大学某处生活污水(pH=7.48,COD =136.1mg/L,浊度=16.5NTU,氨氮=33.7mg/L)100mL,加一定量自制的高铁酸钾,在室温下用六联定时搅拌器进行烧杯搅拌,首先以300 r/min的转速快搅1min,然后以50 r/min的转速慢搅15min,此时紫色褪去。再静置沉淀20min后,取20.00mL上层清液水样,测其COD、浊度和氨氮的浓度。污染指标的测试方法分别为:COD采用重铬酸钾法;浊度采用分光光度法;氨氮采用纳氏试剂比色法[5]。
2 结果与讨论
2.1高铁酸钾制备
2.1.1原料用量的选择
Fe(NO3)·39H2O应适量。因为过量的硝酸铁电离 出多余Fe3+会与产物发生副反应[6],从而降低高铁酸盐的纯度和产率,所以Fe(NO3)·39H2O不能过量。 NaOH应充分过量。因为高铁酸盐在中性溶液中不稳定,易水解,而在强碱条件下,FeO42-可稳定存在,不易发生水解反应。所以NaOH应充分过量,从而始终保持溶液呈强碱性,避免FeO42-分解。
NaClO应适当过量。由于原料间的反应强烈放热,而NaClO室温就易分解成NaCl和O2,因此Na- ClO应过量,从而保证其分解一部分后仍能完全氧化硝酸铁,避免发生副反应。
试验表明,NaClO实际用量/理论用量小于1.2 (即NaClO过量不超过20%)时,高铁酸钾产率随 NaClO用量的增加而增加。NaClO实际用量/理论用量大于1.(2即NaClO过量超过20%)时,高铁酸钾产率随NaClO用量的增加反而减少。原因是NaClO 具有还原性,而产物FeO42-具有强氧化性,过量Na- ClO会与高铁酸盐反应,导致其产率降低。NaClO过量20%时,高铁酸钾的产率最大,因此,本试验采用NaClO过量20%。
2.1.2原料投加顺序的选择
合成高铁酸盐有两种不同的原料投加顺序:Na- ClO溶液中依次直接加入NaOH、Fe(NO3)3·9H2O,则主要通过一步反应合成高铁酸盐(称为一步法); NaOH中加Fe(NO3)·39H2O,充分反应后放料、离心、 过滤,去滤液、取滤渣,即得Fe(OH)3,再加NaClO溶液,则通过两步反应合成高铁酸盐(称为二步法)。 两种方法合成的产物纯度都在99%以上,二步 法较一步法中产品纯度、产率都有所提高。原因是二步法中第一步生成Fe(OH)3后去掉了滤液,有效避免了其他离子进入第二步形成杂质引起产物纯度和产率的降低。但二步法较一步法增加了放料、离心、 过滤等步骤,操作更繁琐,而产率、纯度提高不是太明显,因此,本试验采用一步法。
2.1.3合成K2FeO4反应温度和时间的选择
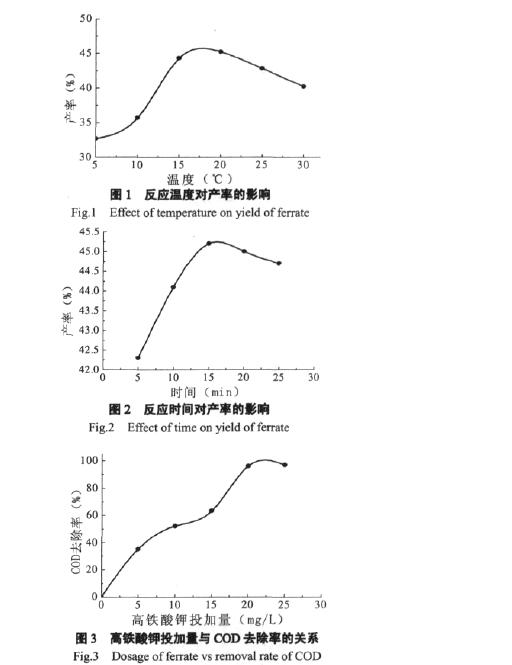 |
图1、图2分别为反应温度、时间对高铁酸钾产率的影响。从图1可知,反应温度控制在15~30℃, 反应15min,高铁酸钾产率总在最大值45.2%左右; 从图2可知,反应时间控制在10~25min,反应温度 20℃,高铁酸钾产率也在最大值45.2%左右。因此合成K2FeO4的反应温度、时间无需严格控制,只要保证其在以上范围即可。原因可能是该反应为非氧化还原反应,而且无明显放热。但从图1、图2中仍可以确定合成K2FeO4的最佳工艺条件为15min,20℃。
2.2高铁酸钾对COD的去除
向原水中投加不同量的高铁酸钾进行氧化去除COD,结果如图3所示。
由图3可见,随着高铁酸钾投加量的增加,原水中COD的去除率也逐渐增加。当高铁酸钾的投加量为10mg/L时,COD的去除率为50%以上;当高铁酸钾的投加量为20mg/L时,COD的去除率达96% 以上。该曲线显现出双峰突跃的形式。这种去除效果的特征说明,在低投加量时主要依靠高铁酸钾溶于水生成Fe(OH)3,从而产生絮凝作用去除水中污染物,降低水体的COD,而高铁酸钾的氧化作用居次要地位;随着投加量的增加,高铁酸钾的氧化去除COD的作用不断增强,并协同絮凝作用,最终使水样COD的去除率达96%以上。
2.3高铁酸钾对浊度的去除
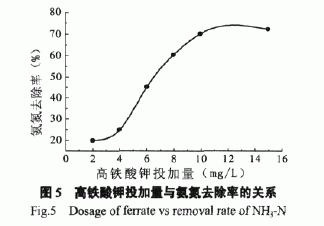
向原水中投加不同量的高铁酸钾,考察对浊度的去除效果。结果如图4所示。
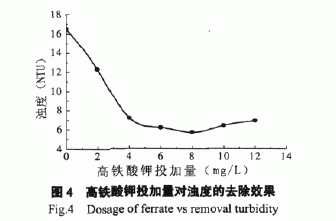 |
由图4可见,高铁酸钾的投加量小于8mg/L 时,水样浊度随高铁酸钾的投加量的增加而减少。这表明高铁酸钾溶于水生成的Fe(OH)3对水中悬浮物具有良好的絮凝沉降作用,从而有效降低水样浊度。
高铁酸钾的投加量超过8mg/L时,水样浊度随高铁酸钾投加量的增加反而逐步增加。这是因为大量的高铁酸钾溶于水生成的Fe(OH)3,其与污水中悬浮物絮凝沉降后,剩余的过量Fe(OH)3会形成胶体导致水样浊度增加。
2.4高铁酸钾对氨氮的去除
向原水中投加不同量的高铁酸钾,得到高铁酸钾投加量与氨氮去除率的关系如图5所示。
 |
由图5可见,随着高铁酸钾投加量的增加,原水中氨氮的去除率也逐渐增加。当高铁酸钾的投加量为10mg/L时,氨氮的去除率为70%以上;继续投加高铁酸钾,氨氮的去除率增加不明显。这表明高铁酸钾对水体中氨氮的去除是其溶于水产生的氧化作用和絮凝作用协同作用的结果,其中氧化作用占主导地位。
3 结论
原材料用量、投加顺序、反应时间、温度等都影响 K2FeO4的纯度和产率。高铁酸钾对生活污水中污染 指标COD、浊度和氨氮能有效去除,从而使其达到再生水的国家标准,实现水资源循环利用。高铁酸钾对 生活污水中COD、浊度和氨氮的有效去除是其溶于水产生的氧化作用和絮凝作用协同作用的结果。
参考文献:
[1]Yong Yong Eng,Virender K Sharma,Ajay K Ray.Ferrate(VI): green chemistry oxidant for degradation of cationic surfactant[J].Chemosphere,2006,63(10):1785-1790
[2]Jia-Qian Jiang,Alex Panagoulopoulos,Mike Bauer,et al.The ap-plication of potassium ferrate for sewage treatment[J].Journal of Environmental Management,2006,79(2):215-220.
[3]罗志勇,李和平,郑泽根.高铁酸钾的合成及其在水处理中的应 用[J].重庆建筑大学学报,2002,24(6):39-43.
[4]Audette R J,Quail J W.Potassium,Rubidium,Cesium,and bari- umferrate:preparation,infrared spectra,and magnetic suscepti- bilities [J].Inorganic Chem,1972,11(8):1904-1908.
[5]国家环保总局.水和废水检测分析方法(第三版)[M].北京:中 国环境科学出版社,1997.
[6]曲久辉,林谡,王立立.高铁酸盐的溶液稳定性及其在水质净化 中的应用[J].环境科学学报,2001,21(6):106-109

使用微信“扫一扫”功能添加“谷腾环保网”









